发育过程中细胞生长和增殖依赖于蛋白质的大量合成,在这一高强度的加工过程中难免产生一定数量的“残次品”,即由于蛋白质翻译过程中的随机误差、折叠失败等原因造成的错误折叠蛋白。内质网作为蛋白质加工的工厂,能够缓解蛋白质合成及折叠的压力以协调细胞快速分裂增殖,从而维持机体稳态。当内质网中积累大量未折叠蛋白则会导致细胞内质网应激(ER Stress),激活未折叠蛋白反应(Unfolded Protein Response,UPR)通路来重建内质网稳态。当内质网压力超过一定阈值,UPR的激活无法缓解内质网压力时,则将引发细胞凋亡。癌细胞在恶性增殖过程中同样需要大量的蛋白合成,因此有研究表明肿瘤中也会激活UPR,然而肿瘤细胞在内质网应激下的细胞命运的决定一直存在争议。
2022年10月10日,西湖大学生命科学学院马仙珏课题组与李旭课题组合作在PNAS发表了题为Bip-Yorkie interaction determines oncogenic and tumor-suppressive roles of Ire1/Xbp1s activation的研究论文,阐述了UPR的Ire1/Xbp1s分支通过Hippo通路调控器官大小、肠道干细胞稳态、细胞迁移和肿瘤发生发展的分子机制。同时,该文揭示了Bip与Yorkie/YAP互作决定了Ire1/Xbp1s在原发性肿瘤的生长和侵袭中具有双重功能。

论文截图
果蝇幼虫的眼成虫盘是研究肿瘤发生的重要模型,在眼成虫盘的某些特定细胞中引入人体致癌突变可造成细胞异常增殖和肿瘤发生。研究者进一步采用遗传学工具,在复杂的遗传背景下研究不同基因之间的相互作用对于肿瘤发生和迁移的作用。
在这项研究中,作者首先在果蝇中构建不同类型的恶性肿瘤模型发现,UPR均被显著激活。UPR激活可通过内质网膜上的三个跨膜“传感器”蛋白(Ire1、Perk和Atf6)启动一系列从内质网到核的信号转导途径来重建内质网稳态。为探究UPR各个分支在肿瘤发生发展中的作用,作者采用基因过表达和RNA干扰技术,发现过表达Ire1/Xbp1s特异地激活Hippo信号通路从而抑制肿瘤生长。

图1.Ire1/Xbp1s抑制Yorkie介导的肿瘤生长
Hippo信号通路是控制多细胞生物的器官尺寸大小的主要调节信号通路。作者就此提出问题,这种进化上最保守的应激通路Ire1/Xbp1s分支的激活,是否一方面缓解内质网中蛋白质合成和折叠压力,另一方面可通过激活Hippo信号限制细胞生长和增殖,从而调控器官大小和发育?
作者通过遗传分析发现,Hippo信号通路下游效应器Yorkie在Ire1/Xbp1调控器官大小中是必需的。在接下来的工作中,作者进一步发现Bip作为Xbp1s的下游关键调节因子,可通过与Yorkie互作,使其锚定在细胞质,限制其入核,从而调控器官大小和抑制肿瘤生长。另外,作者还发现Ire1/Xbp1s/Bip的表达量也受到Hippo通路紧密调控,提示存在一种UPR信号调控Hippo信号通路的负反馈制衡机制。
Hippo信号在肠道干细胞的自我更新与分化以及损伤修复中同样扮演着重要作用。果蝇肠道上皮的建立和维持需要严格控制肠道干细胞的增殖和分化,这种细胞稳态的破坏会导致肠道功能异常,如肿瘤生长。作者发现在正常内稳态和损伤重建期间,Ire1/Xbp1s/Bip通过抑制果蝇成体肠道组织中的Yorkie信号活性,从而调节肠道干细胞数量。

图2.Ire1/Xbp1s调控肠道干细胞稳态
意想不到的是,在Xbp1缺失的果蝇肿瘤模型中,肿瘤体积增大的同时肿瘤的侵袭却被显著抑制。作者进一步利用翅成虫盘作为研究细胞侵袭和上皮间充质转化的体内模型,发现Ire1/Xbp1s由于抑制了Yorkie-dMyc/dMax和Yorkie-bantam途径,反而激活了JNK信号通路,从而促进生理性的细胞迁移和肿瘤发生中的细胞侵袭以及上皮间充质转化。

图3.Ire1/Xbp1s抑制Yorkie活性,继而激活JNK介导的细胞迁移和侵袭
最后,作者探究Xbp1s/Bip是否在哺乳动物细胞中调控Hippo信号通路,在肿瘤发生中具有重要作用。作者通过生物信息学分析发现,XBP1(Xbp1s哺乳动物同源基因)表达水平在三阴性乳腺癌显著低表达,反而在其他四种乳腺癌亚型中显著高表达。XBP1和HSPA5(Bip哺乳动物同源基因)的mRNA水平和蛋白水平与患者的不良预后显著负相关。
另外,XBP1的表达水平与YAP(Yorkie哺乳动物同源基因)的多个靶基因的表达水平显著负相关。作者进一步采用细胞核质蛋白分离、Duolink邻位连接技术、免疫共沉淀和蛋白质体外结合实验等方法,在三阴性乳腺癌细胞系中证实HSPA5与YAP发生相互作用,限制YAP的核定位。与果蝇肿瘤模型的发现一致地是,尽管过表达XBP1s和HSPA5显著抑制了三阴性乳腺癌移植瘤的生长,也同样促进细胞的迁移和侵袭。
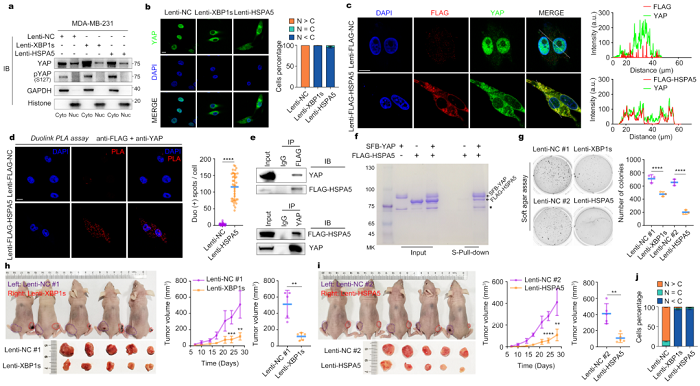
图4.XBP1s/HSPA5通过限制YAP核定位抑制三阴性乳腺癌移植瘤的生长
总的来说,此项工作采用细胞、果蝇和小鼠模型揭示UPR的Ire1/Xbp1s分支通过调控Hippo信号通路,在器官大小,肠道稳态,细胞迁移和肿瘤发生发展中具有重要作用。马仙珏团队的发现也提示了XBP1s/HSPA5通路和YAP通路在原发性肿瘤的生长和转移中具有双重功能。尽管如此,作者也呼吁谨慎和仔细地设计靶向这两类信号通路途径在乳腺癌的癌症治疗。







