阿兹海默等多种神经系统疾病病理生理过程中都有神经炎症的参与。神经炎症是一种由小胶质细胞和星形胶质细胞介导的免疫反应,会损伤神经元、抑制神经再生,阻碍了疾病的治疗和恢复。因此,开发神经炎症调节类药物可以降低疾病恶化,改善神经功能,具有十分重要的研究意义和临床价值。然而,血脑屏障的存在阻止了目前绝大部分药物进入神经系统发挥抗炎及免疫调节作用,使得药物开发困难重重。
对此,中山大学附属第三医院邱伟教授联合国家纳米科学中心聂广军研究员等展开了相关研究。近日,他们在国际知名材料科学期刊Nano Today(中科院一区Top,IF=20.722)发表了题为“Regulation of Neuroinflammation with GLP-1 Receptor Targeting Nanostructures to Alleviate Alzheimer’s Symptoms in Disease Models”的研究论文。国家纳米科学中心聂广军和王海研究员、河北师范大学常彦忠教授为共同通讯作者,赵宜鹏博士后(中山大学附属第三医院)、田丝雨博士(河北师范大学)和张杰博士(国家纳米科学中心)为论文共同第一作者。
该研究设计了一种可穿透血脑屏障(BBB)的新型GLP-1受体激动剂纳米药物,能显著抑制中枢神经系统(CNS)炎性小胶质细胞—星形胶质细胞的激活,调节CNS免疫反应,缓解神经系统功能性损伤。邱伟教授团队联合聂广军研究员团队通过PEG2000和脑靶向肽angiopep-2修饰GLP-1受体激动剂-利拉鲁肽,开发出新型纳米结构药物pALRGT,使其能够有效穿透血脑屏障,并在中枢神经系统发挥免疫调节功能。利拉鲁肽作为一种GLP-1受体激动剂,能够通过PI3K-AKT信号通路降低转录NF-κB的磷酸化水平,从而抑制小胶质细胞的激活和促炎因子的分泌。此外,利拉鲁肽还阻止了活化小胶质细胞引起的反应性星形胶质细胞的生成,并促进IL-3的分泌以恢复小胶质细胞的正常生理功能(图1)。pALRGT在保留了利拉鲁肽中枢免疫调节功能的同时,大大增强对血脑屏障的穿透能力。通过外周注射pALRGT,能够显著降低小鼠脑部海马区域淀粉样蛋白堆积引起的神经炎症,缓解神经元损伤,从而改善其认知功能(图2)。
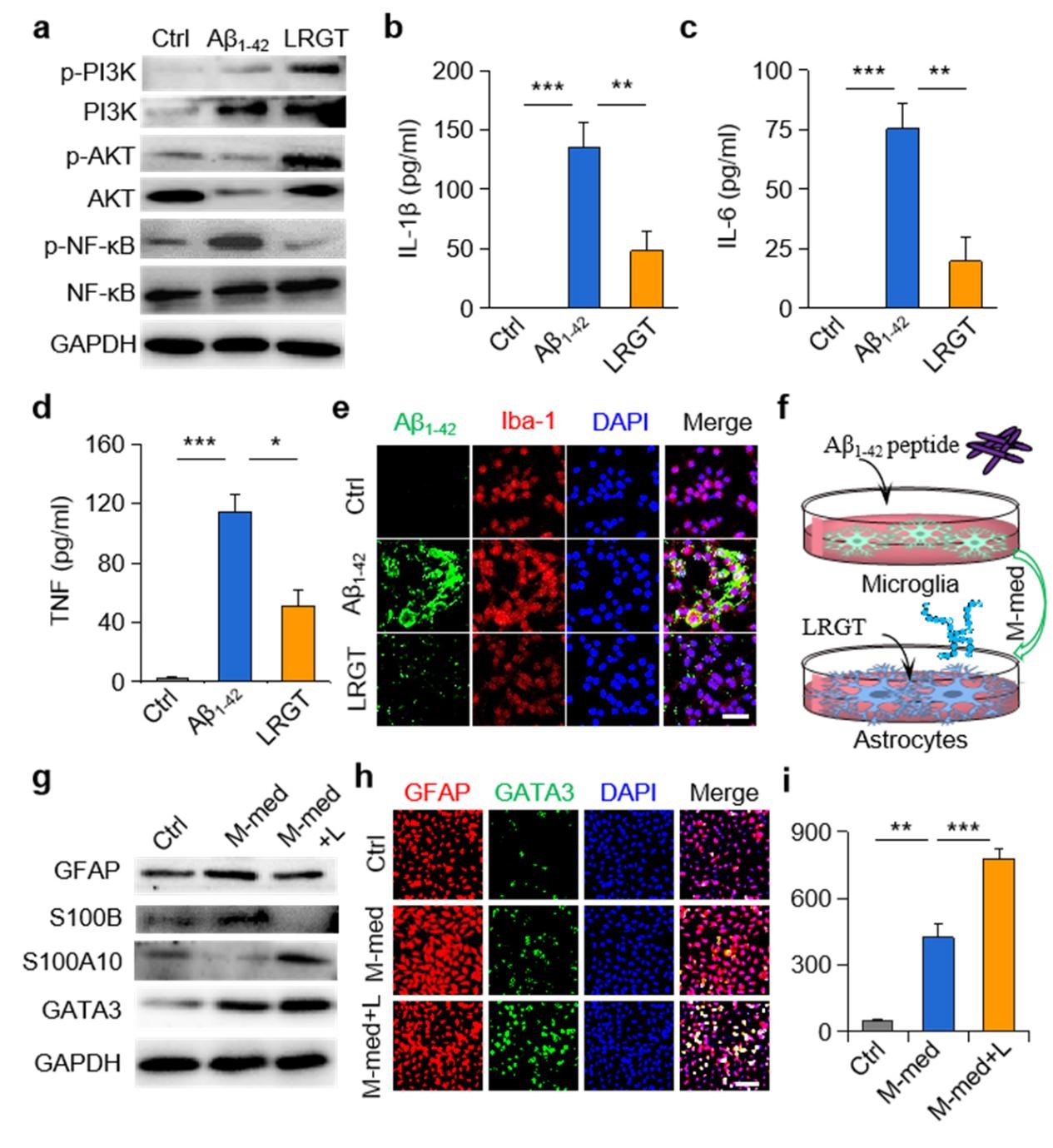
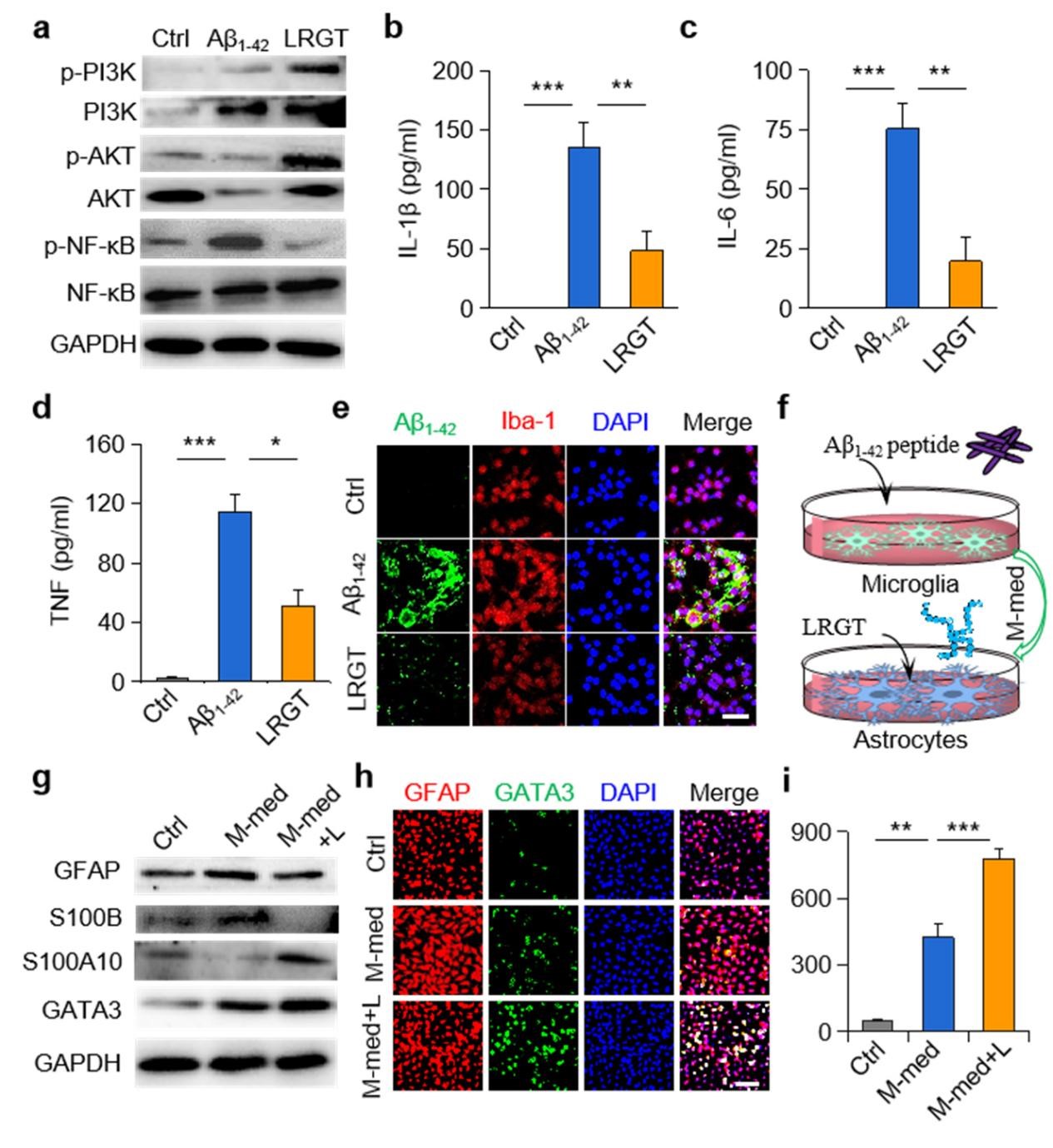
图1:利拉鲁肽降低小胶质细胞NF-κB的磷酸化水平(a),减少促炎因子浓度(b-d)并促进Aβ蛋白的清除(e);利拉鲁肽抑制小胶质细胞对星形胶质细胞的激活(f-g),通过转录因子GATA3(h)促进IL-3的分泌(i)
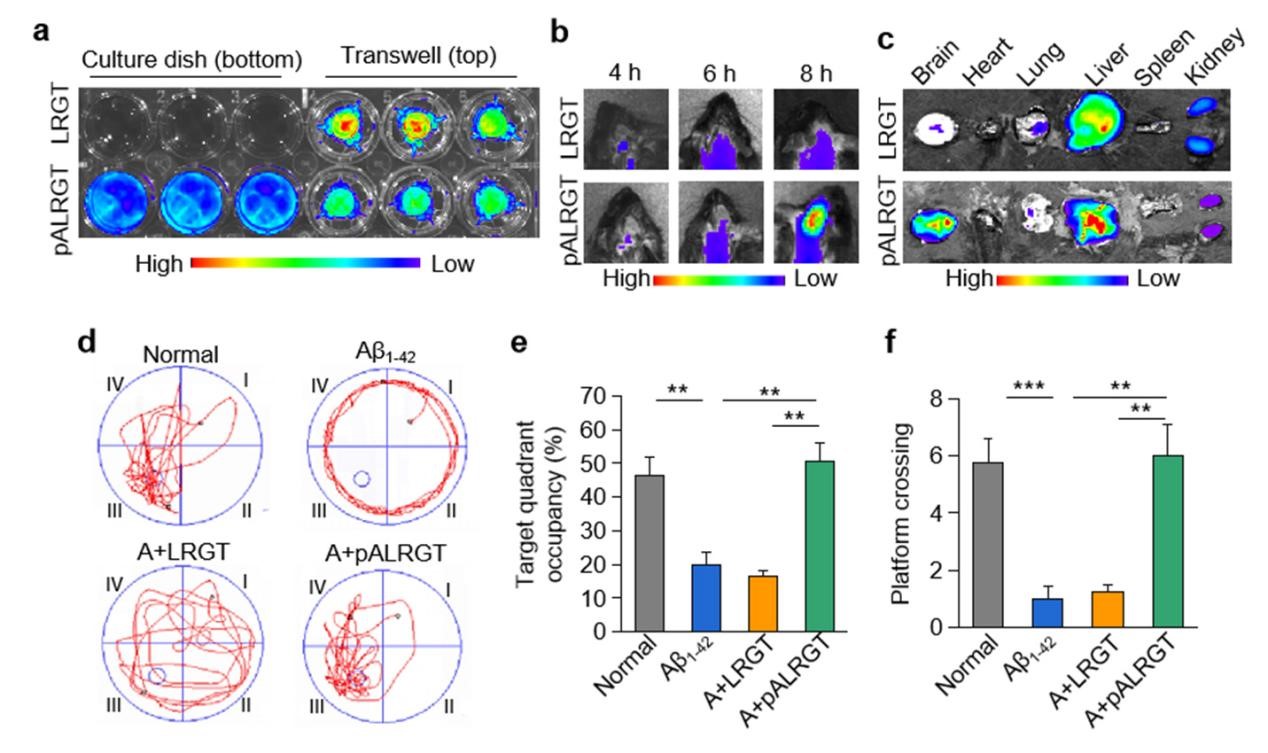
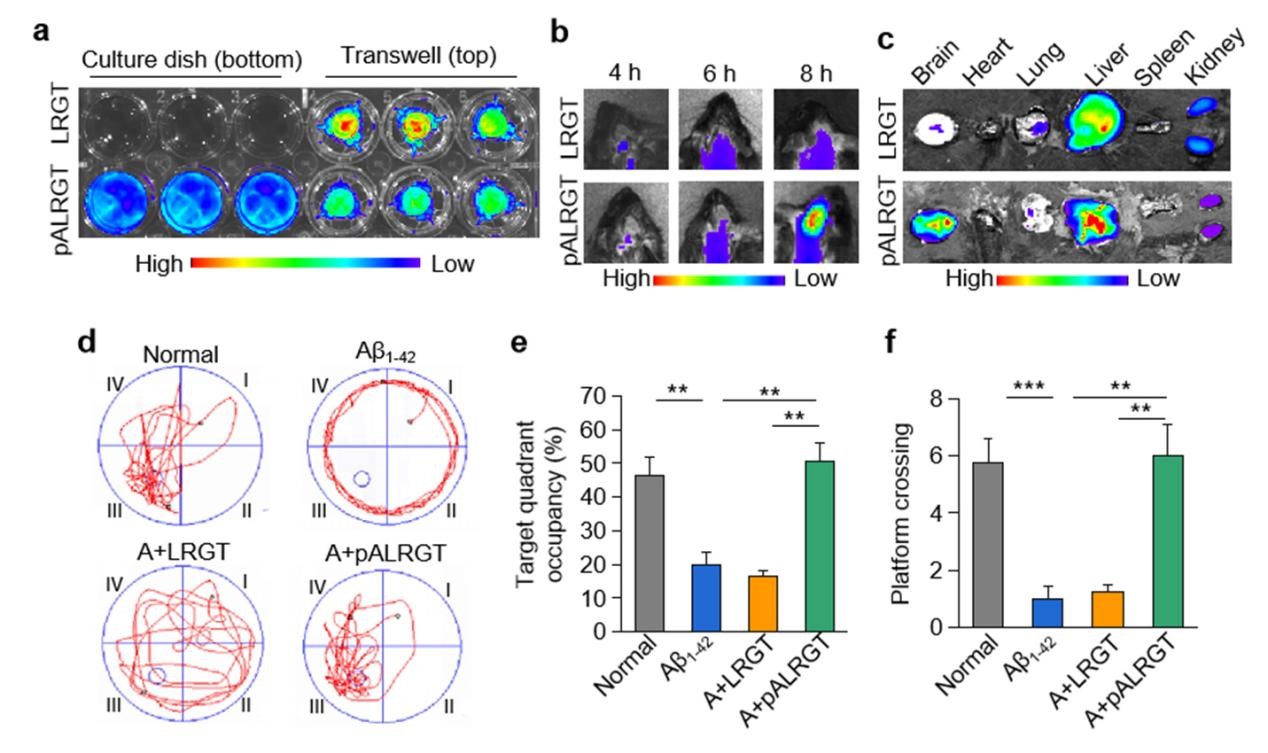
图2:通过小鼠模型证实,pALRGT能有效穿透血脑屏障(a-c),改善小鼠认知功能(d-f)
该课题系统性地研究了小胶质细胞-星形胶质细胞在免疫炎性环境中的相互作用,证实GLP-1受体激动剂可用于调节小胶质细胞和星形胶质细胞引起的免疫炎症,pALRGT以其高BBB穿透性、高安全性、合成简单快速等特点,未来有望有用于神经系统免疫及炎性疾病的临床治疗(图3)。
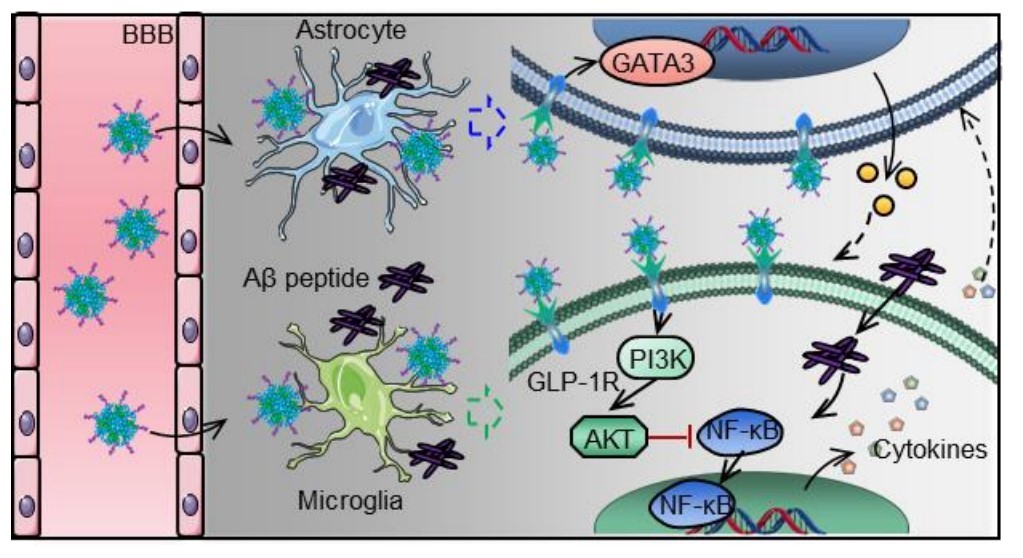
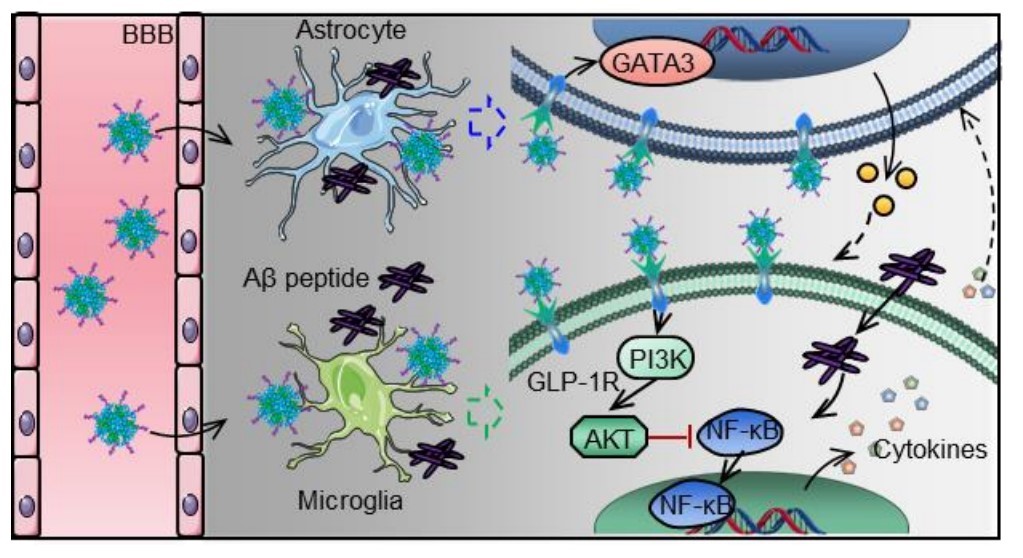
图3:纳米药物pALRGT穿过血脑屏障,调节中枢神经系统免疫炎症反应的示意图
借助纳米医学进行脑病研究已成为科学前沿方向之一。为对接国家脑计划,2020年10月中山大学附属第三医院与广东粤港澳大湾区国家纳米科技创新研究院(广纳院)签署协议,达成战略合作关系。2021年2月医院率先成立“纳米医学中心”,与干细胞(细胞)平台、大数据人工智能平台共同组成医院三大科研支撑平台,同时聘任国家纳米科学中心赵宇亮院士担任医院纳米医学中心学术指导委员会主任。本研究即为双方合作框架下产出的成果。未来医院脑病中心及纳米医学中心仍将与国家纳米科学中心和广纳院共同携手,充分发挥纳米医学在脑疾病诊疗中的价值,推动纳米医学研究成果的临床转化。







