2021年9月,中山大学附属口腔医院寇晓星研究员团队在ACS Nano (影响因子15.9)发表了题为“Apoptotic Extracellular Vesicles Ameliorate Multiple Myeloma by Restoring Fas-Mediated Apoptosis”的研究论文,在凋亡囊泡(apoptotic extracellular vesicle,apoEV)生物治疗领域取得了新的突破。细胞凋亡是维持机体内稳态的关键,并会产生大量凋亡囊泡。细胞凋亡的异常与自身免疫性疾病,神经系统疾病,肿瘤等的发生密切相关。以往研究认为机体产生的凋亡囊泡被吞噬细胞摄入、降解。 2018年,该团队首次在Cell Research (DOI:10.1038/s41422-018-0070-2)杂志发表研究论文,阐明凋亡囊泡可以维持体内间充质干细胞(Mesenchymal stem cell, MSC)及骨组织稳态;并首次以骨质疏松为例提出干细胞来源凋亡囊泡作为新的生物治疗手段用于治疗疾病。
多发性骨髓瘤 (Multiple myeloma, MM) 是第二常见的血液系统恶性肿瘤,会导致包括溶骨性病变、骨痛、贫血、肾功能障碍等多种临床症状,通常被认为是一种无法治愈的疾病。包括多发性骨髓瘤在内的许多肿瘤细胞膜表面的凋亡受体Fas的表达会减少,Fas介导的细胞凋亡处于失活状态,使得肿瘤细胞能够逃逸FasL/Fas通路介导的细胞凋亡。
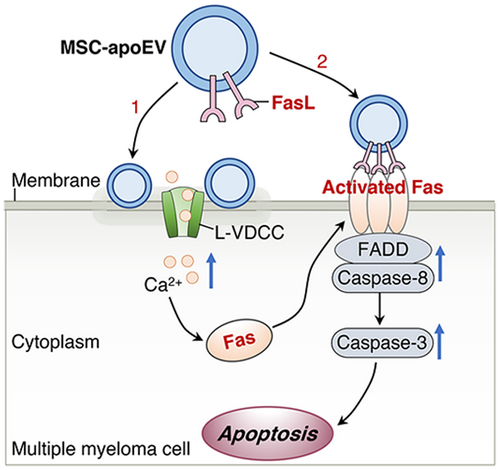

凋亡囊泡通过 “一石二鸟”的策略治疗多发性骨髓瘤模式图
该研究发现,MSC凋亡过程中产生的凋亡囊泡表面高表达细胞死亡相关信号如FasL等。并发现:(1) 全身输注MSC来源凋亡囊泡可显着延长多发性骨髓瘤小鼠的寿命,挽救溶骨性病变,改善肾损伤;(2)凋亡囊泡在体内外均可诱导多发性骨髓瘤细胞凋亡,抑制肿瘤细胞生长;(3)凋亡囊泡直接接触肿瘤细胞,通过诱发Ca2+内流促进Fas从细胞质转运到细胞膜表面;(4)凋亡囊泡利用其膜表达的FasL激活肿瘤细胞中恢复正常的Fas通路以启动细胞凋亡。研究揭示了凋亡囊泡在诱导肿瘤细胞凋亡中的作用,并提出凋亡囊泡以一种“一石二鸟”的策略治疗多发性骨髓瘤的新方法。这一发现为理解细胞外囊泡与肿瘤相互作用增加了新的认识,也为修饰凋亡囊泡、开发新的肿瘤治疗方法开辟了道路。
这项工作得到了广东高层次医院建设计划,珠江人才计划,中山大学青年教师重点培育计划等多个项目的支持。







