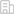卵巢癌是一种常见的妇科肿瘤,病死率在妇科肿瘤中一直居于首位。基于铂类药物的化疗是卵巢癌的一线疗法。铂类药物早期疗效显著,但多数患者最终会因对铂类药物的耐药而出现肿瘤复发。阐明卵巢癌铂耐药机制对于提高卵巢癌的治疗水平具有重要的理论和临床实践意义。一直以来,围绕着药物运输、DNA损伤修复、细胞存活通路调节等方面,研究人员开展了大量关于卵巢癌铂耐药的基础研究,极大地拓展了对于卵巢癌铂耐药的认识,但是目前的研究也存在临床转化潜力不足,机制解析不系统的问题。进一步贴近临床并系统阐明铂耐药机制是卵巢癌的重要研究方向。
近日,中山医学院生化教研室潘超云副教授团队在国际肿瘤学经典期刊 Oncogene (IF: 9.867) 在线发表了题为:ROS-regulated phosphorylation of ITPKB by CAMK2G drives cisplatin resistance in ovarian cancer的研究论文。这是潘超云副教授继2019年6月和2019年10月在The Journal of Clinical Investigation、2021年8月在Nature Communications 发表的关于卵巢癌铂耐药机制研究的系列文章后,又一研究成果。
潘超云副教授团队利用商业化激酶抑制剂库对临床相关的激酶靶点进行高通量顺铂合成致死筛选,发现钙/钙调蛋白依赖性蛋白激酶 II (CAMKII)是促进卵巢癌铂耐药的重要激酶,抑制CAMKII可显著增强卵巢癌对顺铂的敏感性。
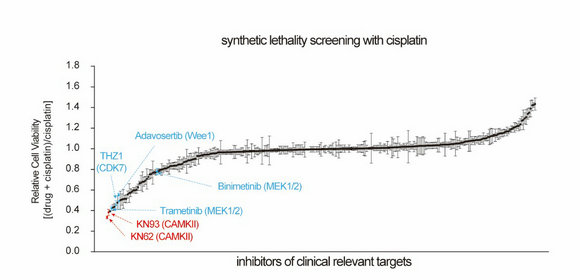
图示:通量顺铂合成致死筛选发现CAMKII靶点
研究团队对CAMKII 促进卵巢癌铂耐药的机制进行系统解析,发现:CAMKII 同工酶 CAMK2G 在维持顺铂杀伤下的卵巢癌细胞内氧化还原稳态的调控中发挥重要作用;CAMK2G是铂耐药卵巢癌细胞内重要的ROS感受器。通过代谢分析、质谱、shRNA筛选等实验,研究发现卵巢癌细胞内源性的ROS升高并直接氧化修饰CAMK2G Met281/Met282 位点导致CAMK2G启动激活(priming)。启动激活后的CAMK2G直接磷酸化下游激酶ITPKB S174位点而增强ITPKB激酶活性,提高细胞内ITPKB的代谢产物磷酸肌醇IP4的水平。而高水平的IP4显著限制了顺铂诱导下的NOX4活性的急剧上升,降低NOX4产生的ROS水平,避免ROS诱发启动细胞凋亡。而NOX4产生的低水平ROS进一步刺激CAMK2G-pITPKB 的活化,从而在反馈回路中抑制顺铂诱导的NOX4激活,促进铂类药物杀伤下细胞内的氧化还原态的再平衡。因此,通过ROS-CAMK2G-pITPKB -NOX4 的稳态环路,没有杀死卵巢癌细胞的铂类药物可能使卵巢癌细胞耐药程度变的更强,ROS-CAMK2G-pITPKB-NOX4 通路揭示了一种典型的固有以及获得性铂耐药的混合机制。
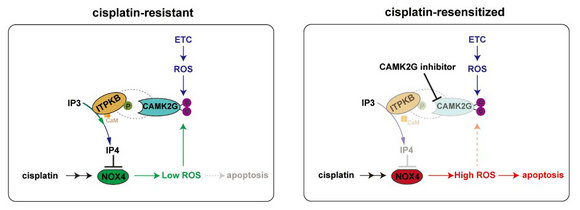

图示:ROS-CAMK2G-pITPKB -NOX4 环路促进卵巢癌氧化还原稳态的作用机制图
本论文第一作者为中山大学附属第一医院妇产科博士后李洁,硕士生郑翠苗对本项研究有重要贡献,中山医学院潘超云副教授是本文通讯作者。该研究得到了中山大学中山医学院-附属第一医院先进医学技术研究中心、广东省恶性肿瘤表观遗传与基因调控重点实验室开放项目、国家自然科学基金以及广东省自然科学基金等支持。