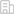2022年3月30日,国际化学领域顶级期刊Journal of the American Chemical Society(JACS, IF=15.419)在线发表了我校中药学院孔令义教授团队的最新研究成果"Oxidative Damage Induces a Vacancy G-Quadruplex that Binds Guanine Metabolites: Solution Structure of a cGMP Fill-in Vacancy G-Quadruplex in the Oxidized BLM Gene Promoter"。王凯波特聘研究员和刘玉霜博士后为本文的共同第一作者,孔令义教授和美国普渡大学Danzhou Yang教授为本文的通讯作者,中国药科大学为本文第一通讯单位。
该研究发现,基因组中富含鸟嘌呤(G)的DNA序列,在Hoogsteen氢键和钾或钠离子的稳定作用下,可以形成一种特殊的DNA二级结构,即DNA G-四链体(G4)。G4在端粒和癌基因的启动子区域大量存在,它们调控着癌基因的复制、转录、翻译等过程,维护基因组稳定,对癌细胞的生长、增殖、侵袭和永生化等至关重要,是重要的癌症生物标志物。此外,与双链DNA明显不同的是,G4可与小分子化合物特异性结合从而干扰癌基因的表达,最终杀灭癌细胞。因此,DNA G4被认为抗癌药物研究中是最具潜力的新靶点之一。
核磁共振技术(NMR)广泛应用于小分子化合物结构解析,且在生物大分子(如核酸,蛋白质等)结构解析中也发挥着重要作用。特别是在DNA G4的结构解析中,NMR技术能够解析接近人体生理溶液环境下的G4结构,相较于X-单晶衍射技术具有明显优势。
在该项工作中,研究者广泛采用NMR,ECD,MST和EMSA等技术手段,发现氧化损伤(ROS)可诱导人源BLM基因启动子序列形成缺口G4,且该缺口G4可以被cGMP等天然鸟嘌呤代谢物填充和稳定。通过进一步采集各种2D NMR 图谱(包括NOESY、COSY、HSQC等),结合分子动力学模拟,解析了cGMP与该缺口G4结合复合物的NMR溶液结构。此外,研究者通过分析多种体内鸟嘌呤代谢物和抗病毒药物与该缺口G4的相互作用情况,为生命体的基因表达调控提出了新机制。本研究通过解析cGMP−BLM-vG4复合物的结构,为鸟嘌呤衍生物类抗癌药物设计提供了结构指导和新思路;同时也为基于氧化损伤形成缺口G4天然小分子抗癌药物研究提供了理论基础。
该项研究工作获得了国家自然科学基金、江苏省自然科学基金、中国药科大学高层次海外引进人才基金等资助。
文章链接:https://pubs.acs.org/doi/10.1021/jacs.2c00435

NMR解析的cGMP−BLM-vG4复合物结构图(PDB ID: 7WGW)