3月22日,中国科学院大学博士毕业生Md. Abdul Mazid、骆志伟、刘传宇、刘龙奇和李文娟在《自然》(Nature)上在线发表了题为“Rolling back of human pluripotent stem cells to an 8-cell embryo-like stage”的文章,报道在体外建立并解析人8细胞期胚胎样细胞方面的研究取得进展。其中,Md. Abdul Mazid为学校2020届生命科学学院孟加拉国博士毕业生,培养单位为中国科学院广州生物医药与健康研究院。该生在校期间受到“中国科学院-发展中国家科学院”院长奖学金资助。
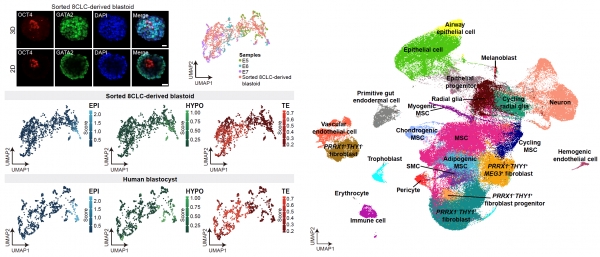
该研究是中国科学院广州生物医药与健康研究院联合国内外多个研究团队,开发了一种非转基因、快速且可控的重编程方法,首次真正将人多能干细胞(PSC)诱导为全能性的8细胞期胚胎样细胞(8CLC)。基于华大自主开发的单细胞建库测序平台(DNBelab C4),研究人员应用单细胞测序技术分析确定了8CLC与人8细胞期胚胎的高度相似性,构建了转化过程的关键分子事件和基因调控网络,并进一步证明产生的8CLC全能性细胞具有在体外或体内以类囊胚和畸胎瘤等形式产生胚胎和胚外谱系的能力。
人类受精卵形成初期,自身基因不表达,而需要依赖卵子携带的母源因子执行细胞功能。随着受精卵的不断分裂,当到达8细胞期时,母源因子逐渐降解消除,而胚胎自身的基因被激活,个体开始依赖自身的基因表达完成后续发育。8细胞期发生的该过程被称作合子基因组激活(ZGA),是胚胎发育的关键节点,该过程的异常可直接导致胚胎发育的停止。因此,对8细胞期细胞调控机制的研究至关重要。然而,受限于胚胎材料的来源和伦理考量,人类8细胞期的研究仍几乎处于空白。中国科学院广州生物医药与健康研究院联合华大研究院首次建立了体外全能性8细胞胚胎样细胞的诱导和提纯方法,并利用单细胞测序技术在多个诱导时间点完整的描绘了8细胞胚胎样细胞诱导过程中转录组和染色质开放性的动态变化(https://db.cngb.org/search/project/CNP0001454/),为研究人类8细胞期的合子基因组激活和发育调控提供了重要的平台和资源,将拓展我们对人类早期胚胎发育的有限认知。
人8细胞样细胞的诱导方法及其与体内胚胎的比较
研究团队首先通过系统性的筛选,获得了一个非转基因、稳定、快速的8CLC诱导培养基。利用华大自主研发的可方便携带、易上手操作、低建库测序成本的DNBelab C4平台,研究人员对8CLC诱导过程进行了单细胞转录组和染色质开放性测序,详细分析了8CLC群体的特征。文章从多个角度证明了8CLC与人8细胞期胚胎细胞的高度相似性,并根据分析结果设计构建了可用于筛选纯化8CLC的报告基因细胞系,该细胞系能够帮助研究人员大量纯化8CLC进行功能和机制研究。作者随后提供了8CLC转换的分子路线图,并且剖析了其中的调控网络,鉴定出DPPA3和TPRX1为诱导8CLC的两个核心转录因子。最后,利用纯化的8CLC,研究人员从滋养层细胞分化能力、模拟人类囊胚形成能力和畸胎瘤分化过程中产生胚外组织细胞的能力等方面系统评估了8CLC的分化潜能,证明其具有胚胎的三胚层和胚外的滋养层发育潜能,即具有全能性。8CLC在功能层面上与人类8细胞期细胞的分化能力契合,是研究人类早期胚胎发育的可靠材料。
利用8CLC构建的类囊胚和畸胎瘤展示出8CLC的发育全能性
该研究项目填补了体外人8细胞期胚胎样细胞的空白。与人多能性状态的细胞相比,全能性的8CLC具有更好的发育和获能能力等众多优势。该成果对早期胚胎发育相关的基础研究提供了新的体外研究体系,有助于我们理解早期胚胎发育过程及其调控网络与疾病发生的关系,为防治出生缺陷及多种发育源性疾病提供理论基础和可行路径;同时也为全能性细胞用于细胞治疗和疾病建模提供了更好的模型选择。科研团队将会进一步建立高效率、高纯度的人8CLC全能性细胞生产平台,并利用全能性细胞制备功能性细胞和药物筛选平台。
Md. Abdul Mazid、Carl Ward、骆志伟和刘传宇为该论文的共同第一作者;Miguel A. Esteban,李文娟,刘龙奇和Md. Abdul Mazid为论文的共同通讯作者。该项目受到国家重点研发计划、中科院战略先导项目等的支持。