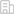尽管近年来靶向治疗、免疫治疗等越来越多的新型肿瘤治疗方案进入临床,化疗仍然是目前临床肿瘤治疗的主要手段。但大多数肿瘤或早或晚都会对化疗产生耐药性,从而复发和进展。目前肿瘤化疗耐受的分子机制尚待进一步解析。肌层浸润型膀胱癌(Muscle-invasive bladder cancer,MIBC)是最为常见和恶性的泌尿系统肿瘤,以顺铂为主的化疗是不可手术和转移性MIBC的一线治疗方案,而由于化疗耐药的产生,很大一部分患者会化疗失败,导致肿瘤复发和进展。

我校华西医院生物治疗国家重点实验室陈崇教授、刘玉教授团队联合泌尿外科魏强教授于2022年9月12日在Cancer Cell发表研究论文Acquired semi-squamatization during chemotherapy suggests differentiation as a therapeutic strategy for bladder cancer,发现了半鳞状分化是膀胱癌化疗耐药的一个新特征,进而提出靶向组织蛋白酶CTSH促进耐药肿瘤细胞终末分化的分化治疗策略。四川大学华西医院生物治疗国家重点实验室和泌尿外科王漫丽博士、陈雪兰博士、谭平博士、博士研究生王怡匀为文章的共同第一作者,四川大学华西医院陈崇教授、刘玉教授、魏强教授为通讯作者。该工作得到了魏于全院士的指导。四川大学黄灿华教授等参与了该研究。
MIBC的动物模型较为缺乏。本研究中,陈崇教授团队构建了p53和Pten缺失、Myc过表达的原发、原位的MIBC小鼠模型。该模型能准确地表征MIBC患者的临床病理特征。利用该模型,团队测试了其对MIBC临床化疗方案(顺铂+吉西他滨)的反应,发现该模型能精准地呈现与临床相似的反应到复发耐药的全过程。
为了解析MIBC化疗耐药的分子机制,团队利用单细胞组学分析构建了MIBC获得性耐药的分子路径。通过barcoding示踪等实验,证实肿瘤细胞谱系可塑性是MIBC获得性耐药的主要途径。结合转录组、蛋白质组等多组学及病理分析,发现逐步的鳞状分化是MIBC获得性耐药的显著特征。临床上,化疗耐受的MIBC也呈现鳞状分化特征,并且鳞状分化评分与患者的预后不良密切相关。进而,团队通过多组学分析发现了耐药MIBC鳞状分化的治疗靶标——组织蛋白酶CTSH。CTSH在小鼠和患者MIBC中随着化疗逐渐上调。敲除CTSH能特异的抑制耐药MIBC的体内体外生长。CTSH抑制剂E64也能有效地抑制耐药的小鼠MIBC和患者PDX的生长,而对化疗敏感的MIBC没有明显作用。团队通过病理分析、分化标志物染色及单细胞组学、转录组、蛋白质组学等分析,发现敲除CTSH或者E64处理后,原先已经呈现一定程度的鳞状分化的MIBC细胞发生了终末鳞状分化。机制上,CTSH抑制后,肿瘤坏死因子(TNF)上调,进而通过TNF受体(TNFR1)及下游的CASPASE-8促进肿瘤细胞终末鳞状分化,并最终发生细胞焦亡。
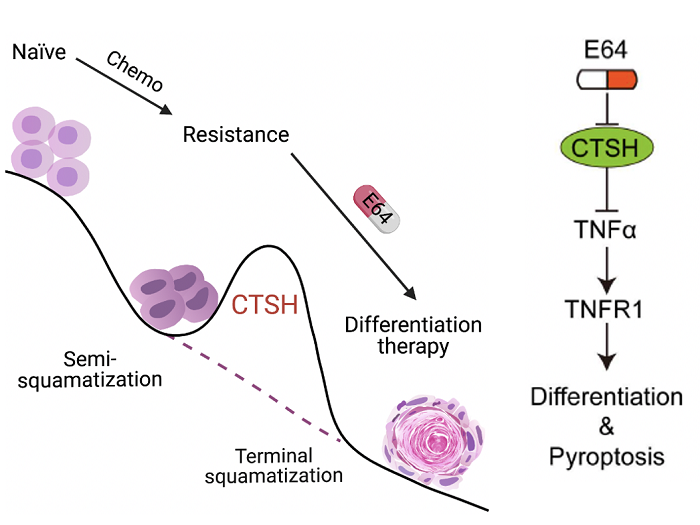
该工作从构建新型精准膀胱癌小鼠模型出发,揭示了MIBC获得性化疗耐药半鳞状分化的谱系可塑性新特征,提出了靶向CTSH促进其终末鳞状分化的分化治疗新策略。虽然分化治疗已经在白血病治疗,特别是我国科学家发展的全反式维甲酸+砷剂治疗急性早幼粒白血病成功应用,但在实体肿瘤中的尝试大多不太成功。本研究可望对实体肿瘤的分化治疗提供新思路。
该项研究工作的主要创新点包括:一是构建了基于基因编辑正常类器官的原发、原位、驱动明确的新型膀胱癌模型,重现了膀胱癌化疗全过程;二是发现了膀胱癌化疗耐受呈现的一种新的谱系可塑性——“半鳞状分化”;三是鉴定了耐药膀胱癌新的治疗靶点CTSH;四是阐明了靶向CTSH治疗耐药膀胱癌的分子细胞机制,提出实体肿瘤的分化治疗策略。
陈崇教授团队长期研究肿瘤发生、转移、耐药的分子机制。通过构建原发、原位、驱动基因明确的“精准肿瘤动物模型”,探究肿瘤发生发展的分子机制,进而基于机制和高通量筛选鉴定治疗靶标和药物。前期发现了血液肿瘤发生、小细胞肺癌转移、膀胱癌化疗耐药等机制,相关工作发表在Nature、Nature Cancer、Cancer Discovery、Cancer Cell、STTT等。
该项研究工作得到国家自然科学基金、科技部重点专项、四川大学华西医院等经费支持。