作为生命的单位,细胞通过细胞膜与外界进行隔离,也通过细胞膜与外界进行信号转导和物质能量交换。细胞膜上有多种元件感受外界的刺激,并实现细胞状态的转变,科学家也可以利用这些元件,在细胞外增加刺激,从而调控细胞命运。在神经生物学中,膜电位就是一种重要的物理化学刺激。
3月16日,西湖大学细胞命运调控实验室在Nature Communications杂志发表研究论文,捕捉了人源电压门控钾离子通道Eag2 (Ether-a-go-go 2)的6个构象,解释了Eag2在响应电压刺激时的延迟整流机制,揭开困扰业内多年的这类延迟响应的电压门控离子通道的面纱。
原文链接:https://www.nature.com/articles/s41467-023-37204-6

论文截图
01、Eag2的电生理特性和结构特征
大鼠Eag2基因在NIH3T3细胞中显示出经典的将体细胞转化为恶性细胞的活性,随后关于Eag1和Eag2的研究都证明了两者能通过细胞周期、细胞体积、p38/MAPK等下游信号通路相关的多种调控机制实现致癌性。此外,人的Eag2(hEag2)突变后还会引发癫痫和自闭症等多种神经相关的疾病。
hEag2作为电压门控钾离子通道呈现为四聚体形式,并具有两个主要元件,跨膜序列S1-S4负责电压转导(Voltage sensor domain,VSD),S5-S6形成孔结构(Pore domain),负责离子通透,S4-S5连接子实现两个元件间的串联。
电生理实验表明,hEag2呈现经典的延迟整流现象(Delay rectifier)和Cole-Moore效应,其背后机制多年来一直未被阐述清楚。
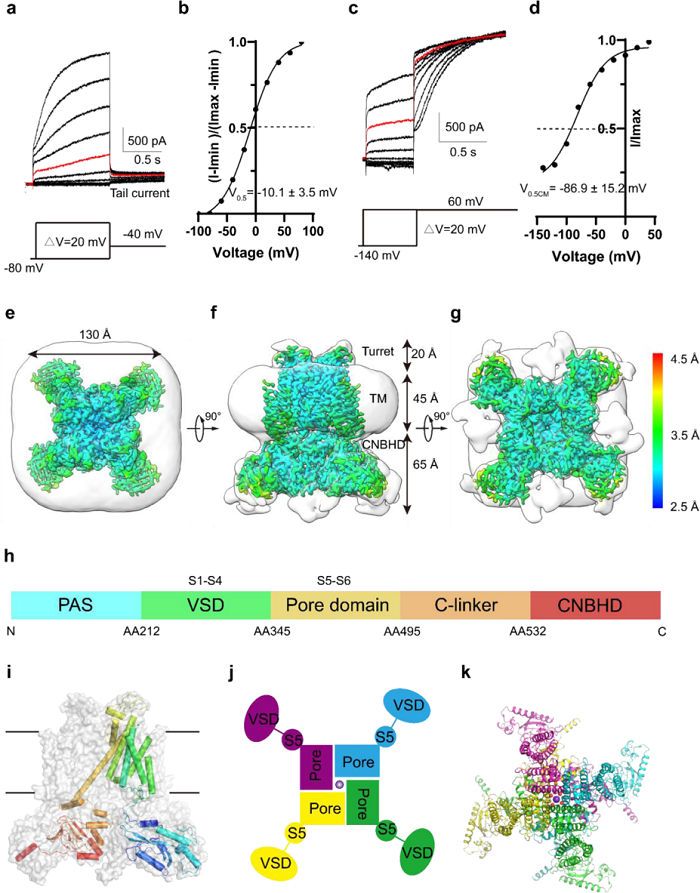
Eag2的电生理特性和结构特征
02、Eag2的逐级开放过程
采用冷冻电镜技术在0mV状态下,捕捉了hEag2从关闭到开放过程的6个不同构象,以接近原子分辨率的结构信息,展现了孔道在受到电压刺激时,逐级开放和通透离子的过程,如下图所示。在关闭状态,Y460和F464通过链内和链间的π-π相互作用,形成了疏水性限制位点,从而防止水化和脱水化的钾离子通过。
在疏水性限制位点的下方,由Q472和T468通过静电相互作用力形成的亲水性限制位点。疏水性限制位点和亲水性限制位点共同形成了长长的通道阀门。钾离子在关闭和预开放1状态下,有6个占位,与常见的钾离子通道5个离子占位相比,呈现出非经典的离子通透路径。
在预开放状态,F464从孔中央甩出,打断了π-π相互作用,使得孔道开到6埃。在预开放2状态下,Q472的密度不再稳定,说明最后一个限制位点被打开,持续的电压将脱水化的钾离子推动到S6位点,通道呈现为转导状态。在开放状态下,F464向S5旋转,与S5上的F365形成新的π-π相互作用。同时,Q472向邻近的S6旋转并与其链上的N466形成相互作用。因此,F464和Q472共同扮演了门控和稳定hEag2的角色。
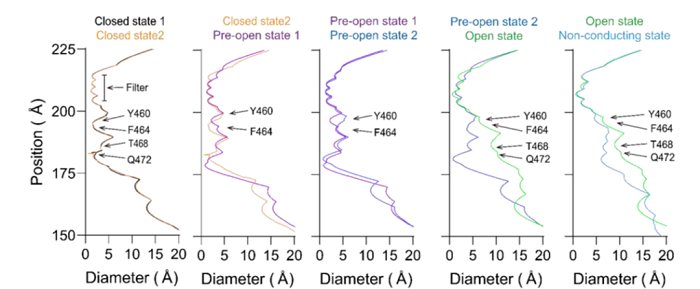
hEag2孔道逐级开放过程
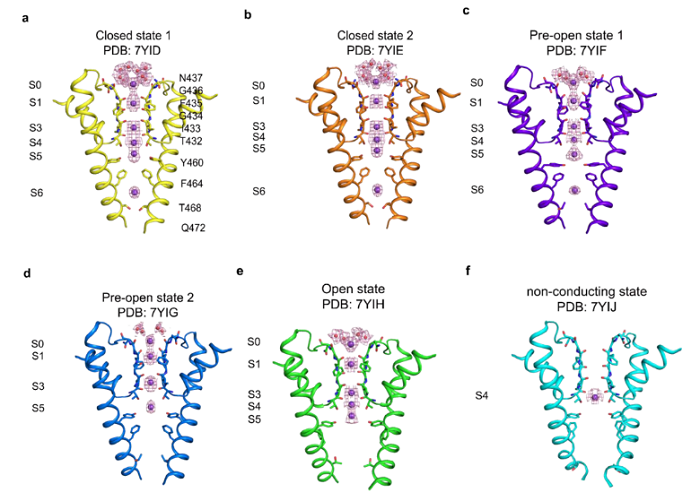
hEag2在持续电压刺激下通透离子的过程
03、hEag2延迟整流和Cole-Moore效应的机制
离子通道C型失活和N型失活已有一些机制模型,然而延迟整流激活和Cole-Moore效应的机制一直难以理解。通过电生理测试,发现T468A和Q472R两个突变体分别影响了延迟整流激活和Cole-Moore效应,同时对电压敏感性没有明显影响。
结合上述研究结果,猜测在膜电位去极化过程中,hEag2通过打破疏水性限制为点F464的能量壁垒,从关闭态转变到预开放态,进一步的电化学力将驱动钾离子从S5占位到S6占位移动,并且胞内离子进入到限制性位点Q472,通道趋于离子流动状态。同时,去极化的电压作用力越大,通道响应电压刺激的速度越快。综上,解释了hEag2延迟整流和Cole-Moore效应的机制。
04、hEag2电压感受和转导机制
hEag2开放的过程伴随了S5和S6如虹膜般的旋转,该过程由S4-S5连接子将VSD感知的电压信息传递到Pore domain,实现孔道的打开。结合上述结果,总结为在膜电位静息状态下,hEag2处于关闭状态,当膜电位去极化,VSD感受电压的作用,由S4-S5连接子带动S5顺时针旋转(top view)并向远离孔的方向舒张,该过程带动孔径变大,hEag2进入欲打开状态,持续的电压刺激使得VSD和S5进一步变构,此时,hEag2通道被彻底打开。
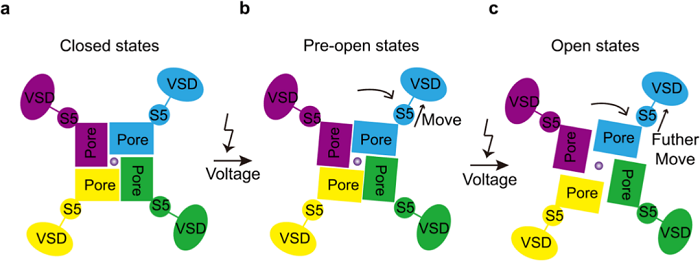
hEag2的电压激活机制
西湖大学生命科学学院讲席教授裴端卿为本文的通讯作者。西湖大学生命科学学院博士研究生章明锋和单圆月为本文的共同第一作者。该研究得到国家自然科学基金委、西湖教育基金会的支持,同时得到西湖大学冷冻电镜平台、高性能计算中心的技术支持。







