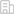细胞受到各种物理因子(电压,力,温度,光线,磁场等)刺激,会做出瞬时或者持续反应。其刺激对细胞命运可塑有着至关重要的作用。同时由于物理刺激,例如光线、磁场、温度等,有着非侵入性的特征,其在非侵入性控制细胞命运方面的应用有着非常重要的潜在应用价值。
西湖大学细胞命运调控实验室继3月份报道人源电压门控钾离子通道Eag2电压感应下的延迟整流机制后1,团队联合Victor Chang心脏研究所在Nature Communications杂志发表题为"A mechanical-coupling mechanism in OSCA/TMEM63 channel mechanosensitivity"的研究论文。
机械敏感离子通道作为细胞直接感应外界力变化的分子在生命体中广泛存在,然而其鉴定却进展缓慢。2021年,来自Scripps研究所的Ardem Patapoutian团队就因为鉴定了人源PIEZO通道获得2021年诺贝尔生理和医学奖2。
OSCA最早由植物渗透压响应缺陷筛选得到3,同时被证明能够在爪蟾卵母细胞中异源表达并对渗透压做出响应4。较PIEZO的低压力响应阈值而言,作者早期鉴定为OSCA/TMEM63属于更高压力响应的机械敏感离子通道,并解析了其原子级的冷冻电镜结构5。
结构显示其与钙离子激活的氯离子通道TMEM166和潜在的负责听力的TMC家族7有着相似的亲缘关系,都显示出二聚体形式的类转运体结构。研究其工作机制不仅对于理解OSCA/TMEM63蛋白如何响应力的变化有着重要的价值,同时对于TMEM16和TMC家族蛋白的工作机制有积极的意义。然而由于各种原因,如不能在冷冻电镜环境下给OSCA/TMEM63施加较大的压力,其工作机制一直难以被解析。
虽然OSCA/TMEM63在进化中高度保守,然而其演化出不同的压力阈值和不同的门控特性的机械力敏感蛋白8。其中人源OSCA/TMEM63A基因在大脑中高度表达,显示出更高压力激活的迷你电导特性9。
作者纯化了人源OSCA/TMEM63A蛋白并解析了其高分辨冷冻电镜结构,意外发现人源OSCA/TMEM63A呈现单聚体形式而并非先前认为的二聚体形式。同时,冷冻电镜结构清晰显示一个磷脂分子阻塞了离子的流经。
巧合的是该磷脂占据的位置与钙离子激活的氯离子通道TMEM16A中钙离子占据的位置类似,表明OSCA/TMEM63A和TMEM16A的激活有着异曲同工的特点:一个被磷脂门控,另一个被钙离子门控。
同时其磷脂阻塞机制与先前研究的细菌中机械敏感离子通道MscS和哺乳动物机械敏感钾离子通道K2P的磷脂阻塞机制类似,表明OSCA/TMEM63虽然在结构上与MscS和K2P有着质的变化,但其都具有相似的脂膜介导的力感应机制。因此OSCA/TMEM63的门控特征结合了TMEM16A,MscS和K2P的门控特征。
进一步为了验证人源的门控特征在二聚体形式的OSCA/TMEM63上是保守的。作者再次纯化了拟南芥OSCA1.1的蛋白并组装了纳米盘来获取更高分辨的冷冻电镜结构。作者得到了2.5Å分辨率的拟南芥OSCA1.1在脂膜环境下的电镜结构。
意外的是,作者发现与他们之前报道的在去垢剂环境下的结构有微弱的区别,其脂膜环境下二聚体中心相互作用处呈现扩张的构象,同时他们发现其扩张的构象可能与内源的溶血卵磷脂介导的,其结构也印证了之前报道的溶血卵磷脂能够促进其激活的现象。
在该高分辨电镜结构下,作者同样看到了其单侧通道区有类似的磷脂分子作为潜在的门控分子,结合在类似于人源OSCA/TMEM63A的磷脂结合处,表明其磷脂门控特性在二聚体形式的OSCA/TMEM63通道上也是保守的。

接着作者解析了二聚体更高压力响应的的拟南芥OSCA3.1的高分辨结构,同样也看到了其单侧通道区有类似的磷脂分子结合在拟南芥OSCA3.1中。有趣的是拟南芥OSCA3.1呈现非常明显的二聚体交界面扩张和紧缩的结构。
而其二聚体的紧缩形式是由每个亚基的第五次和第六次跨膜连接的彼此相互作用所介导的。作者猜测其从紧缩形式的OSCA3.1到扩张形式的OSCA3.1的转变过程可能要打破该相互作用带来的能量壁垒,因此呈现需要更高压力的激活形式。
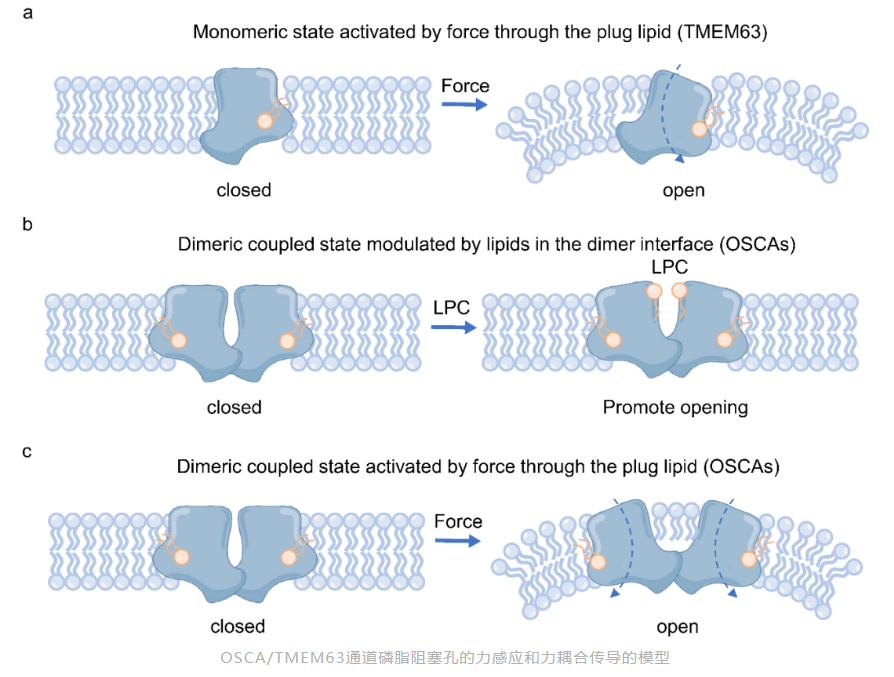
综合上述,基于三套高分辨冷冻电镜结构,作者在磷脂阻塞孔的力感应门控机制基础上,提出了二聚体相互作用产生了力耦合传导的力传递门控机制,为我们理解机械敏感离子通道力感应和传递提出了新的思路。
西湖大学细胞命运调控实验室在讲席教授裴端卿的指导下,将继续在细胞物理感应和可塑的分支方向做出重要原创成果。
西湖大学生命科学学院讲席教授裴端卿为本文的最后通讯作者,西湖大学生命科学学院章明锋和澳大利亚Victor Chang心脏研究所Charles D Cox为共同通讯作者。西湖大学生命科学学院单圆月为本文的共同第一作者。该研究得到国家自然科学基金委、西湖大学教育基金委、国家自然科学基金的大力支持,同时得到西湖大学冷冻电镜平台、高性能计算中心的技术支持。
1.Zhang, M., Shan, Y. & Pei, D. Mechanism underlying delayed rectifying in human voltage-mediated activation Eag2 channel. Nat Commun 14, 1470, doi:10.1038/s41467-023-37204-6 (2023).
2.Ledford, H. & Callaway, E. Medicine Nobel goes to scientists who discovered biology of senses. Nature 598, 246, doi:10.1038/d41586-021-01283-6 (2021).
3.Yuan, F. et al. OSCA1 mediates osmotic-stress-evoked Ca2+ increases vital for osmosensing in Arabidopsis. Nature 514, 367-371, doi:10.1038/nature13593 (2014).
4.Hou, C. et al. DUF221 proteins are a family of osmosensitive calcium-permeable cation channels conserved across eukaryotes. Cell Res 24, 632-635, doi:10.1038/cr.2014.14 (2014).
5.Zhang, M. et al. Structure of the mechanosensitive OSCA channels. Nat Struct Mol Biol 25, 850-858, doi:10.1038/s41594-018-0117-6 (2018).
6.Dang, S. et al. Cryo-EM structures of the TMEM16A calcium-activated chloride channel. Nature 552, 426-429, doi:10.1038/nature25024 (2017).
7.Jeong, H. et al. Structures of the TMC-1 complex illuminate mechanosensory transduction. Nature 610, 796-803, doi:10.1038/s41586-022-05314-8 (2022).
8. Murthy, S. E. et al. OSCA/TMEM63 are an Evolutionarily Conserved Family of Mechanically Activated Ion Channels. Elife 7, doi:10.7554/eLife.41844 (2018).
9.Yan, H. et al. Heterozygous Variants in the Mechanosensitive Ion Channel TMEM63A Result in Transient Hypomyelination during Infancy. Am J Hum Genet 105, 996-1004, doi:10.1016/j.ajhg.2019.09.011 (2019).