- 59 高校采购信息
- 101 科技成果项目
- 3 创新创业项目
- 0 高校项目需求
SARS-CoV-2感染和损伤胆管组织的研究


2020年3月17,复旦大学赵冰、张荣、林鑫华,中国医学科学院基础医学研究所梁俊波合作在生物预印本平台bioRxiv上发表研究成果“Recapitulation of SARS-CoV-2 Infection and Cholangiocyte Damage with Human Liver Organoids”,建立了人源类器官的SARS-COV-2感染模型,确定SARS-COV-2可以感染胆管细胞,并下调胆管组织中细胞紧密连接及胆汁酸转运相关基因的表达,为新冠病毒细胞嗜性、致病机制研究和后续药物研发提供重要工具,并提示胆管功能紊乱可能是部分新型冠状病毒感染者肝脏损伤的诱因。

在本项研究中,研究者应用人源肝脏类器官建立SARS-CoV-2感染模型,并研究其感染和损伤胆管组织的机制。人源类器官是由人体组织体外3D培养产生的,结构功能与体内组织器官高度相似的微型器官,可于体外模拟体内生理病理过程中的组织细胞行为。
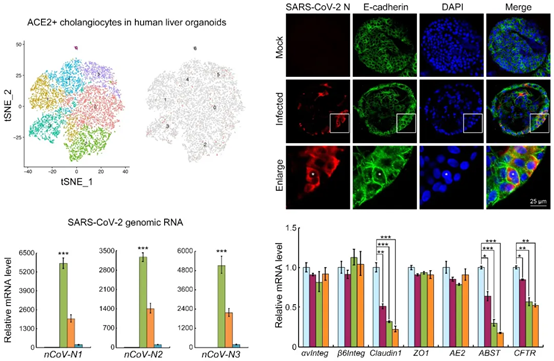
研究者从临床肝脏手术中分离获取人胆管细胞,培育出可稳定传代的肝脏胆管类器官,应用单细胞RNA测序(scRNA-seq)对类器官中胆管细胞进行了转录组分析,发现长期培养的肝脏胆管类器官保存了ACE2+的胆管细胞类群,而此细胞类群在小鼠肝脏胆管类器官中并未发现。提示人肝脏胆管类器官可以模拟ACE2介导的SARS-CoV-2感染。
接下来,研究者检测了类器官对SARS-CoV-2的易感性。研究者从上海一位COVID-19患者中分离并纯化了SARS-CoV-2病毒,接种感染来不同个体的胆管类器官。感染24小时后对类器官进行免疫荧光染色发现,SARS-CoV-2的核衣壳蛋白(N protein)在部分类器官胆管细胞中呈阳性,而未感染对照组无信号,显示病毒已经成功侵染并复制,受感染的胆管细胞还会经膜融合形成合胞体。对SARS-CoV-2基因组RNA的qRT-PCR分析显示,在感染后24小时类器官内的病毒载量显著增加。这些数据表明,人胆管上皮细胞是SARS-CoV-2的易感宿主,并可支持病毒的活跃复制,人源类器官可作为研究病毒嗜性和致病机制的工具。
感染48小时后,类器官内的病毒载量明显下降,提示SARS-CoV-2感染可能导致宿主细胞死亡或抗病毒反应的激活。研究者进而关注和检测了病毒感染对类器官整体行为特性的影响。在体内稳态条件下,胆管的主要功能是将肝实质细胞分泌的胆汁酸转运到胆管腔内排出。胆管细胞之间的紧密连接维持了胆管上皮的屏障功能,对胆汁酸的收集和排泄至关重要。研究者发现SARS-CoV-2感染降低了类器官中Claudin1的表达,提示胆管细胞的屏障功能可能被破坏。更重要的是,两个主要的胆汁酸转运蛋白,顶端钠离子/胆汁酸转运体(ASBT)和囊性纤维化跨膜电导调节(CFTR)的表达在SARS-CoV-2感染后显著下调。这些数据支持SARS-CoV-2感染可以通过下调胆管细胞中紧密连接形成和胆汁酸运输关键基因的表达水平,损伤胆管组织屏障和胆汁酸运输功能。提出COVID-19患者肝内病毒感染诱发胆管功能紊乱和胆汁积淤,进而导致肝脏损伤的可能性。
新型冠状病毒(SARS-COV-2)感染和损伤肝脏中胆管上皮细胞

扫码关注,查看更多科技成果