近日,我校生物工程学院蔡孟浩课题组在毕赤酵母合成生物系统方面取得重要进展,通过设计灵活可控的新型人工转录器件库,实现了天然药物合成途径的精细表达控制,相关成果以“Yeast transcriptional device libraries enable precise synthesis of value-added chemicals from methanol”为题,在线发表于Nucleic Acids Research(《核酸研究》IF=19.610)。
合成生物学技术的快速发展,推动了微生物细胞工厂在生物制造和生物医药领域的广泛应用。针对具有不同生理特性的微生物底盘宿主进行个性化设计和改造,可以满足多样化的生产场景和需求。例如,甲醇作为煤化工主要副产物和二氧化碳直接氧化产物,来源广泛、成本较低、还原度高,具备成为工业生物制造中新型碳源底物的潜力,已引起工业生物界的广泛关注。而开发能代谢利用甲醇的微生物作为底盘宿主用于高附加值产品的生产,已成为合成生物学的研究热点之一。
巴斯德毕赤酵母因其高效的甲醇同化代谢、较完善的翻译后修饰和易于高密度发酵等诸多优势,已在学术界和工业界得到广泛关注,应用于异源蛋白表达以及小分子化学品的生物合成,逐步成为蛋白表达的优选宿主和天然产物合成的高潜力底盘。在毕赤酵母中高效合成复杂结构化合物,需要对产物合成途径的大量基因进行精细化表达调控。然而,与模式宿主如酿酒酵母、大肠杆菌等相比,毕赤酵母作为非常规酵母,仍然缺乏丰富、有效的基因表达调控工具。
该研究中,作者在前期设计转录增益装置的基础上(Science Advances, 2022, 8:eabl5166),进一步分析毕赤酵母转录调控机制并重构转录调控遗传线路,对不同来源和功能的DNA结合蛋白、结合序列、转录因子激活域等特定功能元件进行组合设计,构建了一套输出强度呈连续变化的组成型人工转录器件库cTRDL,库容量达到126个,强度为商业化毕赤酵母PAOX1的16%~520%,整体差异倍数达到32.5倍。在此基础上,通过筛选合适强度范围的甲醇诱导型启动子作为输入启动子,适配人工转录调控核心组件,进一步构建了一套输出强度呈连续变化的甲醇诱导型人工转录器件库iTRDL,库容量达到162个,强度为PAOX1的30%~500%,整体差异倍数达到16.7倍。理论上,两套具有不同调控模式、输出强度连续变化、强度跨度大的人工转录器件库,可为毕赤酵母中重组蛋白表达和复杂小分子产物合成提供更多可选的工具和更为灵活的调控模式。
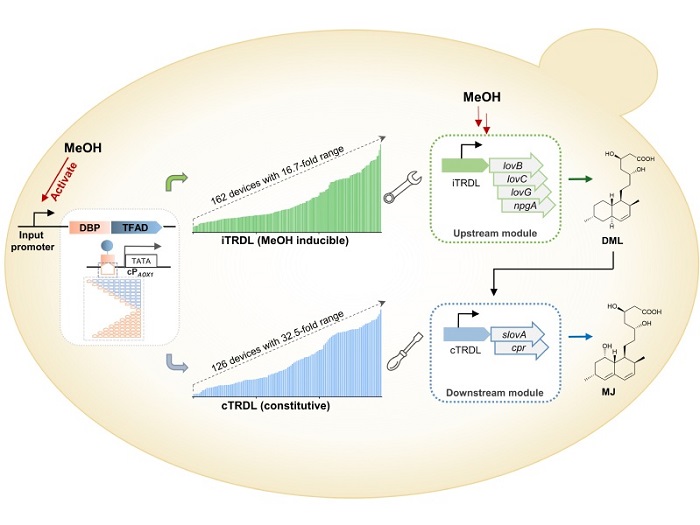
在此基础上,作者选用降血脂上市药物中间体莫纳可林J作为报告化合物,进一步检验了人工转录器件库cTRDL和iTRDL在复杂药物分子合成途径重构和调控中的应用成效。以甲醇为底物,选择iTRDL来源的器件适配平衡上游的聚酮合成模块,通过正交设计成功实现中间产物二氢莫纳克林L的高效合成,产量和产率达到相同培养条件和相同基因剂量下PAOX1表达模式的5.5倍和9.3倍。进一步,选择cTRDL和iTRDL来源的器件分别适配平衡下游氧化过程模块,通过全因子设计对整个途径的6种关键酶进行优化适配和非交互调控,最终实现了模块内和模块间的优化平衡,大幅度提升了目标产物莫纳可林J的合成能力,产量和产率达到相同培养条件和相同基因剂量下PAOX1表达模式3.0倍和5.0倍,且优于PAOX1表达模式的多拷贝基因剂量优筛菌株的产物合成能力,展现了作者所构建的人工器件库的精细调控、灵活可控、高效表达的特性。
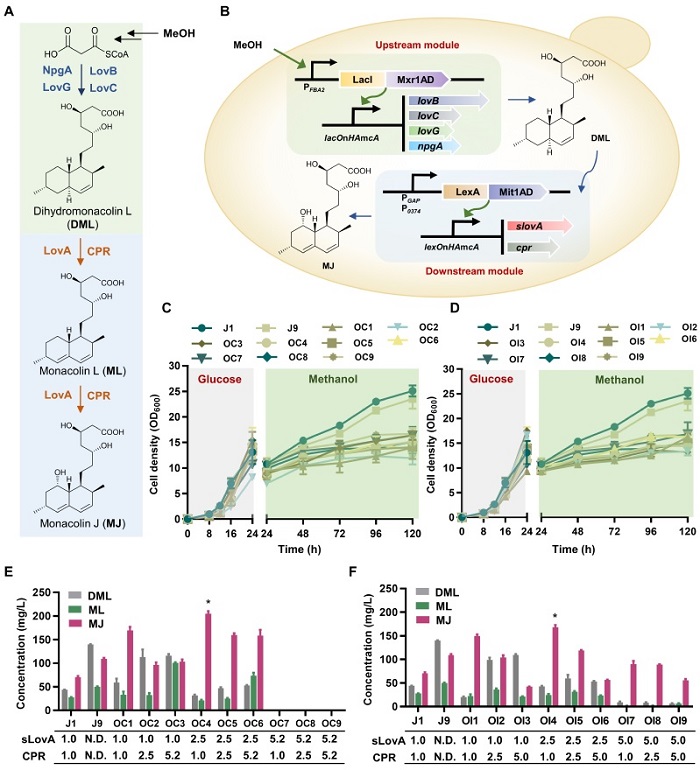
总体而言,该研究基于合成生物学工程化设计理念,开发了毕赤酵母新型人工转录器件库并实现多酶途径的精细表达控制,为其他高附件值复杂结构天然药物及化学品的生物合成提供了新的思路和策略,进一步拓展了毕赤酵母在合成生物学及代谢工程领域的应用潜力。
该论文第一作者为博士生朱巧云,通讯作者为蔡孟浩副教授,研究工作得到国家重点研发计划、国家自然科学基金、上海市青年科技启明星、上海市细胞代谢光遗传学技术前沿科学研究基地等项目的资助。







