肿瘤干细胞(CSCs)是肿瘤的“种子”细胞,具有自我更新和多向分化的潜能,在肿瘤的发生、发展和耐药中发挥重要的作用,靶向CSCs对于治疗肿瘤具有重要的意义。但CSCs在肿瘤组织中的占比非常小,且缺乏有效标志物,导致难以有效分离和富集CSCs,进而限制了靶向CSCs的研究与药物开发。近年来,为实现CSCs的分离与富集,国内外的研究者提出了诸多方法,如悬滴法、克隆形成法、水凝胶微囊法和基于超低吸附培养的成球实验等,但依旧面临着耗时耗力、成本高、干细胞富集球体不均匀和难以高通量等问题。
近日,清华大学机械工程系熊卓和张婷课题组在学术期刊《Small》发表题为”3D打印的甲基丙烯酸酐化明胶-纳米黏土水凝胶通过激活Wnt/β-catenin信号通路诱导结直肠癌肿瘤干细胞”(3DBioprintedGelMA-NanoclayHydrogelsinduceColorectalCancerStemCellsthroughActivatingWnt/β-cateninSignaling)的研究论文。该研究基于生物3D打印研发了一种结直肠癌CSCs高效诱导与富集的新方法,探究了生物材料诱导CSCs的新机制,为CSCs研究和靶向CSCs的高通量药物筛选提供了一种高效模型。
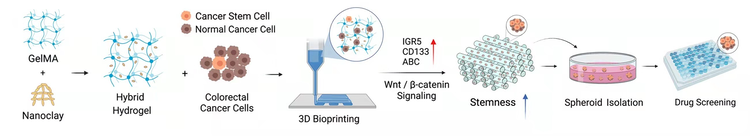
图1. 3D打印GelMA-nanoclay水凝胶诱导富集肿瘤干细胞示意图
作者研究发现甲基丙烯酸酐化明胶(GelMA)和纳米粘土(nanoclay)制备成的杂化水凝胶具有良好的打印性能、孔隙率和接近体内肿瘤的力学性能。结合生物3D打印,该杂化水凝胶能高效促进结直肠癌细胞的成球能力和细胞干性。机制研究表明,该杂化水凝胶主要通过重塑细胞外基质并激活Wnt/β-catenin信号通路从而诱导和富集CSCs,可以作为CSCs诱导和富集的体外模型。与传统的CSCs富集模型相比,通过GelMA-nanoclay水凝胶富集的CSCs微球形态均一,数量更多,具有更强的干性且对靶向CSCs药物更加敏感,因此是肿瘤干细胞分离富集的更优方法。
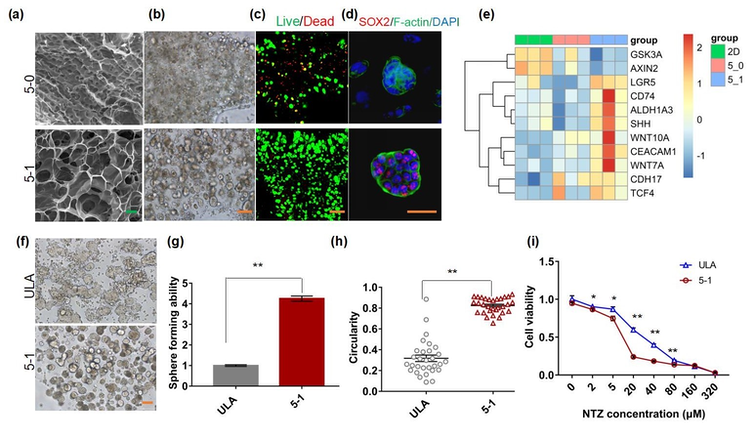
图2. 三维打印的杂化水凝胶具有诱导富集CSCs的特性,其诱导的CSCs球可作为靶向CSCs药物筛选模型。(a-c)杂化水凝胶具有良好的孔隙率和生物相容性;(d-e)杂化水凝胶来源细胞微球的干性增强;(f-i)杂化水凝胶诱导富集的干细胞球更多、更均一且对靶向CSCs药物更加敏感。
清华大学机械系生物制造中心博士后张艳梅为论文第一作者,清华大学机械系熊卓副教授为论文通讯作者。清华大学机械系生物制造中心张婷副研究员、清华大学自动化系古槿副教授和解放军总医院乔治副教授团队共同参与了本研究工作。论文作者还有机械系科研助理王子萱,自动化系2020级博士生胡启帆,机械系2021级博士生骆浩、2018级博士生鲁冰川,解放军总医院主治医师高云鹤,以及机械系博士后周雍森、方永聪。该研究获得清华大学人才引进启动经费基金项目的支持。






