血流感染是威胁人类健康的最严重的感染性疾病,携带荚膜结构的细菌是造成血流感染的最主要的病原体。荚膜对细菌致病性的贡献早已为人熟知,上世纪二十年代,英国微生物学家弗雷德里克·格里菲斯(FrederickGriffith)建立的经典的肺炎链球菌转化实验,发现荚膜与毒力的直接关联,为1942年美国科学家奥斯瓦尔德·艾弗里(OswaldAvery)及其同事证明DNA是遗传基础的伟大发现奠定了基础。人们普遍认为荚膜的主要功能是保护细菌不被血液中的免疫细胞(例如中性粒细胞)吞噬,然而荚膜在体内真实的致病机制仍然缺乏清晰的认知。
针对这个科学问题,清华大学医学院张敬仁课题组利用丰富的临床菌株资源和遗传转化构建的荚膜置换菌株,在小鼠菌血症模型中证明了荚膜的类型(血清型)是直接决定其毒力的关键因素。荚膜对细菌致病性的贡献集中体现在血流感染早期阶段。超过95%的荚膜敲除菌株在感染5分钟内即从血液中清除,而野生型菌株即使在30分钟内仍然有一半以上细菌在血液中存活。系统比较表明,荚膜血清型决定了肺炎链球菌在菌血症早期的清除速度,由快到慢依次为14、18C、23F、19F、19A、9V、7F、6B、5、1、2、8、6A、4和3型,其清除速率与菌株的毒力强弱具有强相关性(图1),可以对菌株的致病性水平进行客观的评价。
3月8日,清华大学医学院传染病研究中心张敬仁课题组在《实验医学期刊》(JournalofExperimentalMedicine)在线发表了题为“荚膜通过干扰肝脏巨噬细胞促进血流病原细菌的致病性”(Functionalvulnerabilityoflivermacrophagestocapsulesdefinesvirulenceofblood-bornebacteria)的研究论文,揭示了荚膜这一关键的致病因子如何影响病原细菌和宿主天然免疫系统的相互作用,进而决定血流感染疾病中病原体和宿主的最终命运。

图1 肺炎链球菌荚膜血清型决定菌株的毒力水平和菌血症早期清除速率
宿主的免疫系统如何区分不同毒力的肺炎链球菌呢?进一步研究发现,早期血液中快速清除的荚膜敲除菌株和低毒力菌株并非被血液中的免疫细胞杀死,而是被肝脏截留,特别是低毒力14型菌株,在感染5分钟后98.7%的细菌富集在肝脏。与之形成鲜明的对比,代表性高毒力8型菌株仅有11.6%被肝脏捕获。肝脏包含多种天然免疫细胞,包括驻留巨噬细胞——枯否细胞(Kupffercell,KC)、中性粒细胞和单核细胞等吞噬细胞。利用特异性消耗策略,该课题组证实肝脏KC是早期清除无荚膜和低毒力荚膜型菌株的关键免疫细胞。借助先进的活体免疫荧光成像(IVM)技术,课题组实时观测到了肝脏微环境中KC对不同荚膜型肺炎链球菌的捕捉(图2),为研究宿主天然免疫和病原体的互作提供了崭新的视角。
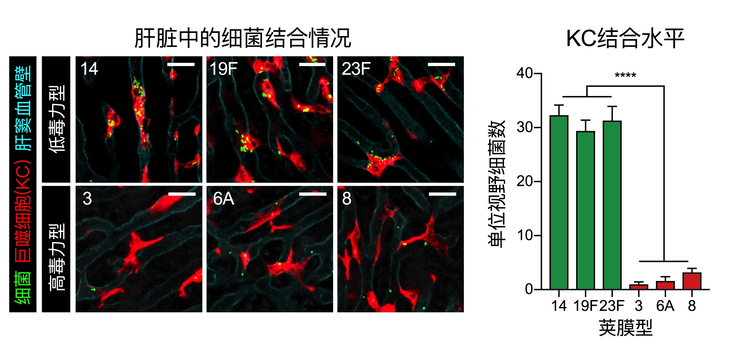
图2 不同荚膜型肺炎链球菌与肝脏KC的相互作用
细菌的荚膜是如何影响肝脏KC的免疫功能呢?由于荚膜置换菌株仅仅存在荚膜的差异,因此荚膜多糖(capsularpolysaccharide,CPS)是介导肝脏KC和细菌相互作用的关键,课题组推测荚膜多糖是KC上天然免疫受体识别的配体,实验结果证实了这一猜想。在提前注射纯化的CPS条件下,小鼠对低毒力荚膜型菌株的清除速率急剧降低,并且呈现剂量和类型的依赖性,IVM显示CPS确实阻碍了肝脏KC对细菌的结合;反之,高毒力菌株的CPS不会影响早期免疫清除。以上结果表明低毒力荚膜型CPS能够被KC上的特异性受体识别,从而介导了这些菌株的快速清除,而高毒力荚膜型CPS能逃逸KC的免疫监视。在此基础上,课题组成功鉴定到了去唾液酸糖蛋白受体(ASGR)是14型肺炎链球菌CPS的受体,并且在体外和体内验证了ASGR对肝脏KC清除14型肺炎链球菌的免疫功能。此外,ASGR还能够结合7F型荚膜多糖。更重要的是,课题组利用细胞系和人原代KC模型证实了人源ASGR同样是人KC上重要的天然免疫受体。
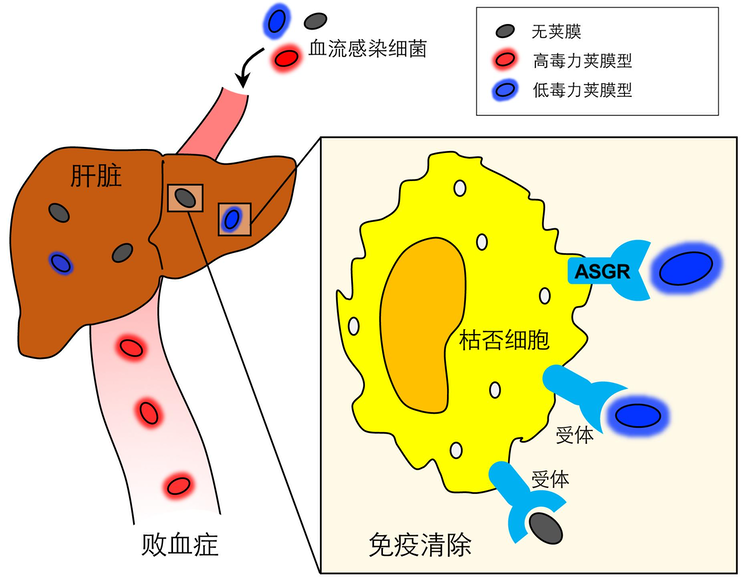
图3 血流感染中细菌荚膜促进病原体逃逸肝脏天然免疫的新机制
上述研究工作开创性地提出了细菌荚膜与肝脏KC免疫受体的特异性相互作用,作为宿主和病原菌博弈的关键阶段,最终决定了菌血症感染疾病的两种截然相反的发展趋势——免疫清除或免疫逃逸。
清华大学医学院张敬仁教授是论文的通讯作者,张敬仁课题组已出站博士后安浩然、2016级博士生钱晨韵、2017级博士生黄益嘉、已毕业博士生李靖和2018级博士生田献彬为论文的共同第一作者。清华大学实验动物中心、细胞生物学平台、共享仪器平台以及蛋白质化学与组学平台为本研究工作提供了重要帮助。该研究工作获得了国家自然科学基金、清华-北大生命科学联合中心、清华大学春风基金和中国博士后科学基金的共同资助。






