早期胚胎发育起始于高度特化的精子和卵子的结合,从而形成全能性的受精卵。在这个过程中,表观遗传信息重编程对于擦除亲本表观遗传记忆和重建细胞全能性十分重要。研究结果表明,哺乳动物早期胚胎发育过程中DNA甲基化会在全基因组范围内发生显著的“擦除-重建”过程。与此截然不同的是,斑马鱼和非洲爪蟾蜍等非哺乳动物早期胚胎发育过程中全基因组DNA甲基化一直维持在相对较高的水平。目前人们对于不同物种在早期胚胎发育过程中为什么选择完全不同的DNA甲基化重编程模式并不清楚。
脊椎动物的基因组大部分区域通常都是高甲基化的,而只有调控序列会出现低甲基化,并且这种低甲基化与调控序列的活性通常正相关。清华大学生命学院颉伟和孟安明课题组前期的研究结果表明,基因组上的一类重要调控元件增强子在斑马鱼配子受精前后会从低甲基化的状态变成高甲基化的状态,从而去掉亲本的表观遗传学记忆(低甲基化状态)。这种现象被命名为增强子的去记忆化(dememorization)。直到种系特征性发育阶段(斑马鱼胚胎受精后24小时),增强子的DNA甲基化才会被合子表达的TET蛋白特异性地擦除,从而激活下游的细胞特异基因的表达。然而,斑马鱼维持整体甲基化并且增强子去记忆化的功能,以及胚胎增强子如何在高DNA甲基化的基因组环境下激活下游基因表达仍是未解之谜。
为了回答这些问题,清华大学颉伟课题组利用未成熟卵母细胞原位显微注射技术(OMIS),在斑马鱼里建立了DNA甲基转移酶dnmt1的母源敲低模型,证明了全基因组范围内大幅度降低斑马鱼早期胚胎的DNA甲基化水平会导致早期胚胎死亡。这些结果表明,高DNA甲基化是斑马鱼早期胚胎正常发育所必需的。为了研究DNA甲基化擦除引起胚胎死亡的原因,研究人员检测了dnmt1母源敲低胚胎的转录组、组蛋白修饰在基因组内的分布变化。结果显示,DNA甲基化的降低伴随着成体细胞增强子和成体细胞特异表达基因的异常激活,提示增强子的去记忆化以及整体DNA甲基化对维持是沉默体细胞增强子的重要机制。但有趣的是,胚胎增强子也是高甲基化,但并不影响其在胚胎发育过程中发挥功能。为了回答这个问题,研究人员进一步研究发现,斑马鱼早期胚胎的增强子区域CG密度低,使其对DNA甲基化不敏感,而成体细胞的增强子区域CG密度高。所以,在斑马鱼早期胚胎中,高DNA甲基化能够选择性沉默成体细胞的增强子,保障了转录组的时序性。基于以上结果,研究人员揭示了整体DNA甲基化的维持和增强子的去记忆化是斑马鱼早期胚胎发育的转录程序的重要保障,能够防止成体细胞基因的提前激活,调控基因有序表达。
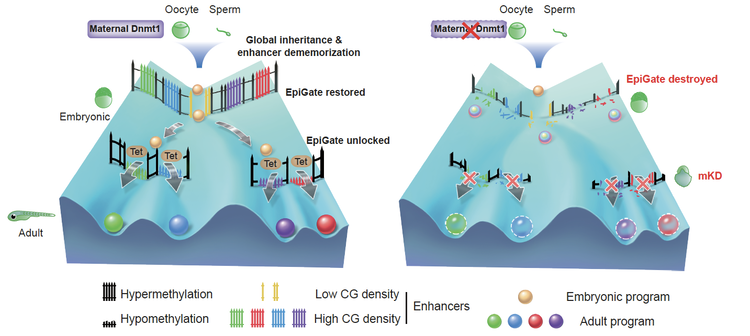
斑马鱼DNA甲基化遗传和增强子去记忆化重塑表观屏障保障胚胎发育
基于上述研究结果,研究人员提出一个模型来解释哺乳动物和其他的脊椎动物为什么采用了不同的DNA甲基化重编程模式。哺乳动物和非哺乳动物可能都是通过改变DNA甲基化水平去除亲本记忆。哺乳动物通过大规模擦除基因组DNA甲基化去除亲本记忆,而斑马鱼等非哺乳动物则通过甲基化增强子区域来去除亲本记忆,最终都达到了重置发育时钟的目的。这项工作不仅回答了斑马鱼早期胚胎发育中DNA甲基化的调控作用,同时加深了我们对于细胞重编程以及全能性获取的理解。
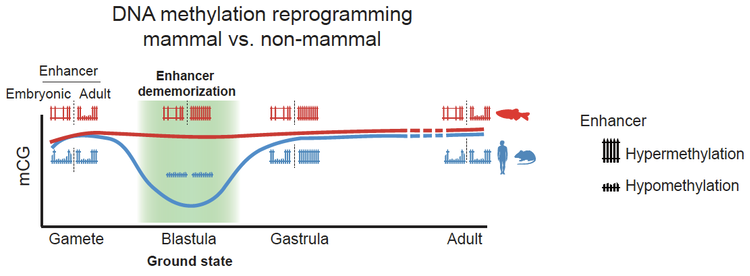
哺乳动物和非哺乳动物分别利用DNA甲基化整体擦除重建以及维持高DNA甲基化并实现增强子去记忆化擦除亲本表观遗传记忆和重置发育时钟
上述研究成果于12月22日在《科学进展》(ScienceAdvances)期刊以长文形式在线发表了题为“DNA甲基化遗传和增强子去记忆化重塑表观屏障保障胚胎发育(Methylomeinheritanceandenhancerdememorizationresetanepigeneticgatesafeguardingembryonicprograms)”的研究论文。
清华大学生命学院颉伟教授为本文的通讯作者,清华-北大生命科学联合中心博士后吴小童、张红梅以及颉伟课题组原博士生张冰洁为本文共同第一作者。清华大学生命学院孟安明教授,日本东京大学的武田裕久(HiroyukiTakeda)教授和其实验室的中村良平(RyoheiNakamura)助理教授,中科院动物所的刘峰教授也在该工作中给与了大力的支持和帮助。该课题得到了清华大学生物医学测试中心的大力协助和支持。该研究获得了国家科技部重点研发计划、国家自然科学基金委、北京市科技计划、清华-北大生命科学联合中心、中国科学院战略性先导研究项目以及美国霍华德休斯医学研究所国际研究学者(HHMIInternationalResearchScholar)的经费支持。






